政策“红利”,创新医疗器械驶入快车道
作者: 来源: 易联智慧云 发布于:2023-11-20 20:19:22 文字:【
大】【
中】【
小】
摘要:
党的十八大以来,医疗器械审评审批制度改革持续激发创新潜能和活力,医疗器械产业发生了翻天覆地的变化,我国部分高端医疗器械实现从跟跑、并跑到领跑的跨越,医疗器械产业发展驶入“快车道”,创新成为行业“主旋律”。

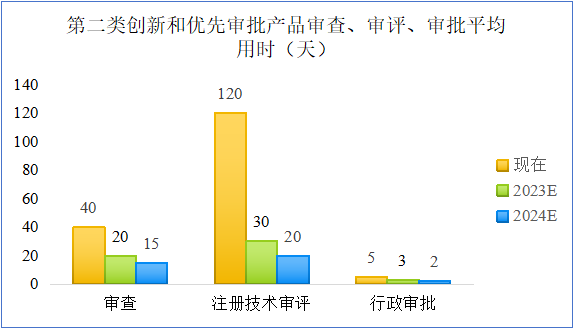
2022年6月,《支持港澳医疗器械注册人在大湾区内地9市生产医疗器械实施方案》发布,明确港澳医疗器械注册人获得国家药监局发放的医疗器械注册证后,可以委托粤港澳大湾区内地9市符合条件的企业生产,进一步推动粤港澳大湾区生物医药产业深度融合,实现粤港澳大湾区医药产业共同发展。2023年5月,粤港澳大湾区药品医疗器械创新发展论坛在澳门举行。论坛提及截至2023年4月,已有10个香港、澳门生产的传统外用中成药通过简化审批在内地上市;通过“港澳药械通”政策累计批准急需进口药品23个,医疗器械13个,极大满足了大湾区人民多种医疗需求。2023年7月11日,国家药品监督管理局召开创新医疗器械报告会,提及截至目前,已批准217个创新医疗器械产品,涵盖重离子治疗系统、质子治疗系统、手术机器人、人工血管等诸多高端医疗器械,部分产品接近或者达到国际先进水平,临床应用价值显著,填补了我国相关领域空白。近年来,国家药监局持续完善法规制度体系,出台促进产业高质量发展规划,强化与有关部门合作,创新审查机制,启动实施监管科学行动计划,拓展监管国际交流与合作,不断推动产业创新高质量发展。国家药监局制定并实施创新医疗器械特别审批程序,加快创新器械的注册速度。具有我国发明专利,在技术上属于国内首创,而且在国际领先,具有显著临床应用价值的医疗器械进入特别审批通道,进行优先审批。进入这个通道以后,主要采取早期介入、专人负责、全程指导,在标准不降低、程序不减少的情况下予以优先审评审批,审评审批时间较其他产品平均缩短83天。其中,境内申请人应当向其所在地的省级药品监督管理部门提出创新医疗器械特别审查申请;境外申请人应当向国家药品监督管理局提出创新医疗器械特别审查申请。2023年8月14日,上海市为支持创新医疗器械在医疗机构开展应用示范,形成“应用示范-反馈改进-水平提升-辐射推广”的创新迭代,提高本市创新医疗器械性能质量,推动产业高质量发展发布了《关于开展2023年上海市创新医疗器械应用示范项目申报的通知》。申报主体由医疗机构与生产企业组成“1+N+1”联合体共同申报。1.植介入器械;2.体外诊断仪器和试剂;3.医用成像器械;4.手术器械;5.治疗器械;6.诊察监护器械;7.康复器械;8.妇产科、辅助生殖器械;9.医用软件;10.其他医疗器械。《通知》中配套支持方面提及,对于列入应用示范项目的创新医疗器械、参与示范项目的单位,在申报高质量发展专项、申请配置相关设施设备、申请相关收费项目和纳入医保支付时予以优先支持。在国家或本市重点项目推介、金融支持、对外合作、宣传推广等方面予以优先支持。2023年10月27日,北京市药品监督管理局印发《医疗器械创新服务提质增效行动方案(2023-2025年)》(京药监发〔2023〕234号),文件针对第二、三类医疗器械审评审批相关要求以及创新驱动发展方向进行相关指导。文件针对第二、三类器械在未来两个年度相关审评、审查、审批时间进行了细致要求,大大缩短了相关产品的过审时间,具体信息统计如下:医疗器械中,第二类创新和优先审批产品的审查、审评、审批所需天数在未来两个年度内均有着明显的下降。其中,注册技术审评天数更是从当下的120天大幅缩减至20天,降幅超过80%。过审时间的大幅缩减,表明政府对医疗器械创新发展的大力支持,在政务上为医疗器械的创新“保驾护航”!2022年,国家药监局按程序做好创新医疗器械、临床急需医疗器械审评审批,高端医疗装备国产化有新突破,批准首个国产质子治疗系统等创新医疗器械55个(总数为189个),优先审批医疗器械77个(总数为126个),创新医疗器械获批数量与2021年相比增加57.1%,更好地满足人民群众使用高水平医疗器械需要。从2014年至2022年,国家药监局共批准189个创新医疗器械。其中,境内创新医疗器械涉及15个省的134家企业,进口创新医疗器械涉及2个国家的8个企业。北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的189个创新医疗器械的82.5%。截至2023年11月13日,国家药监局已批准的创新医疗器械共计236个,其中2023年批准创新医疗器械47个。具体名录如下:创新医疗器械审查程序和要求的规范,审查质量和效率的提升,医疗器械注册人制度,全生命周期监管理念等政策举措,为医疗器械创新发展提供了更加坚实的保障。中国医疗器械产业,正步履坚定,向“新”而行。
附件下载: (已下载0次)
浏览 (16) |
评论 (0) | 评分(0) |
支持(0) |
反对(0) | 发布人:
来源: 易联智慧云
将本文加入收藏夹
标签: