全球首款RET抑制剂终于落地中国,礼来原研信达引进
作者: 来源: 美柏医健 发布于:2022-10-20 17:27:24 文字:【
大】【
中】【
小】
摘要:
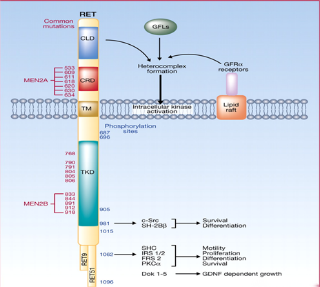
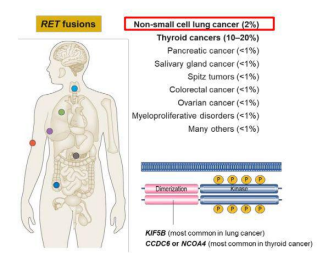
1985年,RET基因被发现,直到2011年才开始陆续有针对RET基因的报道与研究。RET融合和突变发生在多种肿瘤类型中,包括肺癌、甲状腺癌以及其他一些肿瘤类型中,是一个拥有“不限癌种”潜力的靶点。但由于RET融合突变率较低,入局者并不多。塞普替尼作为全球首款高选择性RET抑制剂于2020年5月在美国获批上市,标志着这一靶点靶向药物研究取得了重大突破。如今,这款承载着RET融合突变患者殷切期盼的药物,终于也来到中国了。10月9日,国家药监局已经正式批准高选择性RET抑制剂塞普替尼(40mg&80mg胶囊)的上市申请,用于治疗转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌成人患者、需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌成人和12岁及以上儿童患者、以及需要系统性治疗且放射性碘难治的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上儿童患者。据悉,塞普替尼由礼来制药研发,2022年3月,信达生物从礼来获得塞普替尼在中国的独家商业化权利,全权负责塞普替尼的定价、进口、营销、分销和销售推广。塞普替尼是一种强效、高选择性、口服RET酪氨酸激酶抑制剂,于2020年5月获得美国FDA批准,成为全球首个获批的高选择性RET抑制剂;2021年11月,国家药监局受理了塞普替尼的上市申请,该申请被纳入优先审评审批程序,加速了塞普替尼的获批进程。此次塞普替尼在中国获批是基于全球临床研究LIBRETTO-001的数据和LIBRETTO-321研究中国人群数据。LIBRETTO-001研究是一项评估塞普替尼治疗RET驱动型癌症患者的最大规模的全球I/II期临床试验。研究终点主要的疗效考量是确认的客观缓解率(ORR)和中位缓解持续时间(DoR)。研究结果显示,对于RET融合阳性的局部晚期或转移性非小细胞肺癌患者、RET突变型的晚期或转移性甲状腺髓样癌患者、RET融合阳性的晚期或转移性甲状腺癌患者,塞普替尼显示出有效且持久的抗肿瘤活性及良好的安全性数据。非小细胞肺癌患者中,IRC(独立评审委员会)评估的ORR为84.1%,中位DoR为20.2个月,中位PFS(无进展生存期)为22个月;在247例经治患者中,ORR为61.1%,中位DoR为28.6个月,中位PFS为24.9个月。在未接受过卡博替尼/凡德他尼治疗的142例RET突变的晚期甲状腺髓样癌患者中,IRC评估的ORR为81%,随访2年左右,中位DoR和中位PFS均未达到;在既往接受过卡博替尼/凡德他尼治疗的151例RET突变的晚期甲状腺髓样癌患者中,ORR为73.5%,中位DoR未达到,中位PFS为34个月。在12例初治RET融合阳性的晚期甲状腺癌患者中,IRC评估的ORR为92%,中位DoR未达到,1年PFS率为100%;22例既往接受过系统性治疗的RET融合阳性的晚期甲状腺癌患者,ORR为77%,中位DoR为18个月,1年PFS率为69%。▲来源:https://www.sohu.com/a/591374601_121124374LIBRETTO-321研究,是一项旨在评估塞普替尼用于中国RET变异晚期实体瘤患者疗效与安全性的开放标签、多中心、II期临床试验,共入组77例RET基因变异晚期实体瘤中国患者,包括47例RET融合阳性晚期非小细胞肺癌患者,29例RET突变晚期甲状腺髓样癌患者和1例RET融合阳性晚期甲状腺癌患者。研究结果显示,中国数据与LIBRETTO-001全球数据具有高度一致性,验证了塞普替尼在中国人群中良好的疗效与安全性。在26例纳入主要分析集的非小细胞肺癌患者中,IRC评估的ORR为69.2%,初治患者(8例)ORR为87.5%,经治患者(18例)ORR为61.1%;94.4%的患者在中位随访9.7个月时仍持续缓解。在26例甲状腺髓样癌患者中,IRC评估的ORR为57.7%,初治患者(17例)ORR为58.8%;经治患者(9例)ORR为55.6%;93.3%的患者在中位随访8.7个月后持续缓解。对于入组的1例RET融合阳性的晚期甲状腺癌初治患者已接受23.4周的治疗,并在第8周达到了确认的部分缓解(PR),IRC确定最大肿瘤负荷缩小43%,并且缓解仍在持续。▲来源:https://www.sohu.com/a/591374601_121124374塞普替尼作为全球首款获批的RET抑制剂,本次在中国获批标志着国内精准医疗的又一里程碑达成,将为国内RET变异癌症患者群体带来国际品质的新治疗选择。RET虽然是罕见靶点,但是目前正在被越来越多的药企重视,特别是中国的Biotech,参与的热情不断高涨。RET属于原癌基因,它编码的RET蛋白是一种跨膜蛋白,该蛋白质属于受体酪氨酸激酶家族。酪氨酸激酶家族是涉及几乎所有癌症类型的信号分子家族,同时也是癌症靶向治疗药物研发的基础。酪氨酸激酶家族成员的基因突变是许多不同种类癌症发生发展的主要驱动因素。当RET基因发生突变并被激活时,可能会编码出异常的蛋白质,而异常的RET基因会传递异常信号,并造成在细胞生长、生存、侵袭、转移等多方面的影响。持续的异常信号传递可能造成细胞的过度增殖,因此导致肿瘤的发生和发展。▲来源:Clinical Cancer ResearchRET基因位于染色体10q 11.2上,编码由1100个氨基酸组成的酪氨酸激酶受体,即RET蛋白,其信号的活化可通过下游STAT/PLCγ通路,促进细胞的存活、迁移和生长。RET相关肿瘤发病机制主要有RET基因改变和野生型RET基因的表达异常,其中RET基因改变形式有两种:RET融合及RET突变。2019年ASCO报道了来自56970个多癌种患者的RET改变图谱,结果显示在RET基因改变中RET突变的发生率远高于RET融合,其中RET突变主要包括错义突变(82.5%),而RET融合改变只占RET基因改变的6.4%。尽管RET突变的发生概率远高于RET融合,但绝大多数RET突变并不产生临床意义;而RET融合改变却与多种癌症的发生发展相关,最常见的肿瘤谱非小细胞肺癌2%,甲状腺癌10%-20%,胰腺癌<1%,唾液腺癌<1%,结直肠癌<1%,卵巢癌<1%等。▲来源:https://www.163.com/dy/article/HJ7I0B840534Q32Z.html目前已上市的RET抑制剂以多靶点抑制剂为主,包括仑伐替尼、凡德他尼、卡博替尼、安罗替尼、索拉非尼、舒尼替尼和阿来替尼。这些非特异性多靶点抑制剂整体对于RET基因融合突变的靶向特异性并不强,有效性相对较差,且副作用和非靶向毒性增加。2015年的一项统计显示,使用其它多靶点抑制剂,包括卡博替尼、凡德他尼、舒尼替尼、乐伐替尼和尼达尼布等药物进行治疗,缓解率仅约30%,中位无进展生存期2.3个月,中位总生存期6.8个月。而高选择性RET抑制剂的疗效,从缓解率和缓解时间两个方面突破性地超越了旧有的治疗方案。
全球范围内,除了上述的塞普替尼之外,高选择性RET抑制剂还有来自Blueprint Medicines的普拉替尼,在中国由基石药业独家开发和商业化。普拉替尼于2021年3月在中国获批用于既往接受过含铂化疗的RET融合阳性的局部晚期或转移性非小细胞肺癌,是首款在中国获批上市的高选择性RET抑制剂。2022年3月,普拉替尼的扩展适应症再获批准,包括需要系统性治疗的晚期或转移性转染重排RET突变型甲状腺髓样癌成人和12岁及以上儿童患者的治疗,以及需要系统性治疗且放射性碘难治的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上儿童患者的治疗。在普拉替尼I/II期全球注册临床ARROW研究中,亚裔人群占了很大比重,达到33%;整体客观缓解率(ORR)达到65%,其中既往已经接受过铂类化疗的患者ORR是61%,而初治患者的ORR高达73%,这和以往针对其它靶点的靶向药物疗效几乎相当。普拉替尼不良反应发生率比较低,大多是1-2级而且可控。普拉替尼的另外一个特点是颅内抗肿瘤活性高,因此对伴有脑转移的患者疗效非常好。来源:https://new.qq.com/rain/a/20211217A018IS00这两款率先登陆中国的高选择性RET抑制剂几乎做到了与美国同步上市,这体现了我国药品审评方面取得了很大的进步。那么,中国的Biotech对高选择性RET抑制剂布局如何?据统计,目前在中国进入临床阶段的国产高选择性RET抑制剂共有8款,其中临床II期3款,临床I期5款,尚无进入临床III期的国产项目。A400由科伦博泰研发,该项目于2021年3月向中国国家药监局提交了临床试验申请,并已布局多项国际专利,临床前研究表明A400具有良好的体内外激酶抑制活性和选择性;在动物血/脑暴露量等方面具有优势;对临床已有报道的多种临床耐药突变有效。该项目已于2021年3月License-out给了英国Ellipses Pharma;目前正在中国进行I/II期临床研发。BYS10由白云山研发,在国内的临床试验已经进入II期;在美国用于治疗RET融合或突变的晚期实体瘤的临床试验已于2022年5月获批。SY-5007由首药控股研发,具有足够的毒性/有效性窗口,对RET蛋白及其突变体均有良好抑制效果,临床前试验在动物体内具有良好的抗肿瘤活性,目前正在中国进行I期临床试验为单臂、开放、剂量爬坡和扩展的I期临床研究。此外,国内布局高选择性RET抑制剂的药企还包括海正药业、志健瑞金、润石医药等。
这一两年来,随着PD-1“内卷”带来的启示,一众Biotech开始将目光聚焦在那些差异化的项目上,一些罕见病、罕见靶点得以被重视,这是喜闻乐见的事情,也是监管层引导和规范的结果,虽然这些项目在国内大多处于早期阶段,但在中国日渐完备的医药生产研发体系的加持下,这些项目的进展速度都很快。相信不久的将来,我们将很快看到国产RET抑制剂的成功。【参考资料】
2、《聚焦药靶:靶向RET抑制剂突飞猛进,“小众”突变走入大众视野》,凯莱英,2021-8-113、《又一款“不限癌种”药物获批上市,可治疗14类癌症》,CANCER百科,2022-10-94、《基石药业:RET抑制剂普吉华扩展适应症获批!用于治疗甲状腺》,药融云,2022-3-15
附件下载: (已下载0次)
浏览 (13) |
评论 (0) | 评分(0) |
支持(0) |
反对(0) | 发布人:
来源: 美柏医健
将本文加入收藏夹
标签: